BB娱乐平台登录艾弗森建议收藏 抗体药物关键工艺概述
抗体药物是一种重要的生物制剂,用于治疗多种疾病,如肿瘤、自身免疫性疾病等。抗体药物的生产过程需要经过多个步骤,包括
自1999年国内第一款抗体药物“抗人T细胞CD3鼠单抗”国内上市以来,后面上市几十款抗体主要以进口为主,国产抗体在近五年迎来爆发期,创新能力显著提高,但抗体药物产业链上游主要原材料、设备等长期以来高度依赖进口,国内产商寻找技术突破,在分析设备、耗材、培养设备、培养基等多领域实现国产替代,促进抗体药物研发创新。
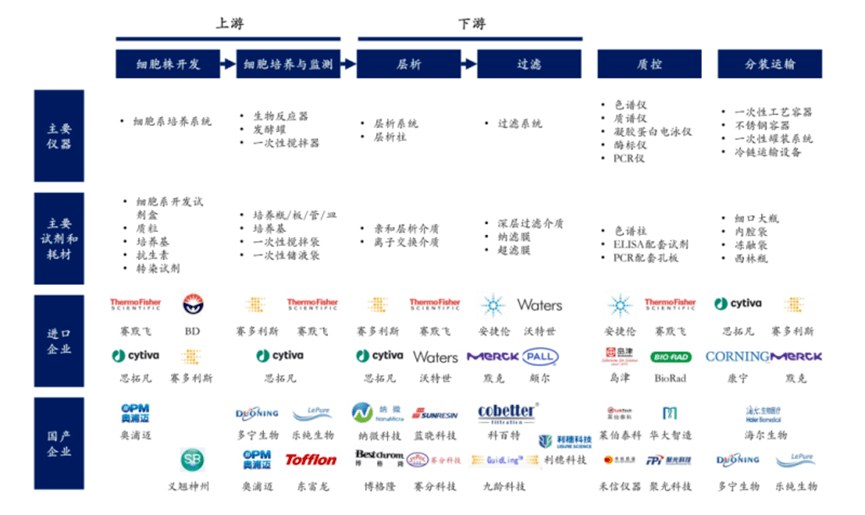
细胞培养是抗体药物生产的第一步,主要是通过培养细胞系来产生目标抗体。哺乳动物细胞是临床抗体药物产品使用的主要表达系统。对于治疗性抗体而言,为了满足其生物活性,需要进行正确的折叠和翻译后修饰,因此用于生产治疗性抗体的宿主细胞往往是哺乳动物细胞,主要包括:Sp2/0骨髓瘤细胞、NS0小鼠骨髓瘤细胞、HEK293人胚胎肾细胞和中国仓鼠卵巢细胞(CHO),其中以CHO细胞用途最为广泛。
(5)CHO细胞是成纤维细胞,几乎不分泌内源性蛋白, 因此对目标重组抗体的分离纯化工作十分有利。
抗体药开发是一个非常复杂的过程,而构建适用于工业生产的高表达的细胞株是最关键的步骤之一,它直接影响了生产的效率和目标产品质量。因此,构建及优化稳定的表达不同外源基因的重组工程细胞株的实验研究至关重要。目前,治疗性重组蛋白在许多诊断和治疗中应用广泛。与合成药物不同,蛋白药物多来源于原核或真核表达系统。如大肠杆菌、哺乳或非哺乳动物细胞、昆虫细胞等细胞系表达系统,以及近几年热门研究的无细胞表达系统。
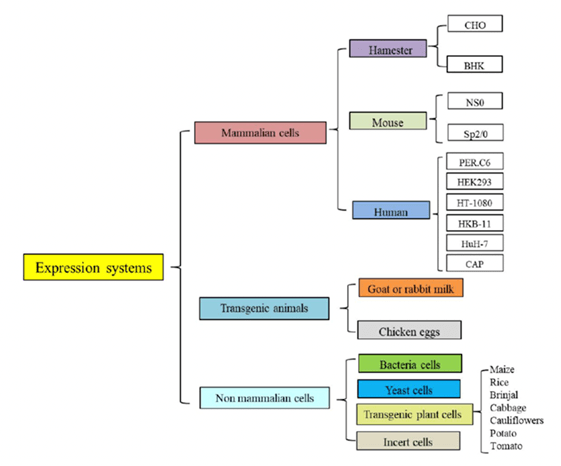
成功的构建工程化细胞株,即从分离高产的哺乳动物细胞株至得到未来用于临床和工程化生产的高产细胞株库,是一个步骤繁琐且漫长的过程,需要做大量的工作才能得到较高产的细胞株。以传统的筛选流程来说,从转染开始至minipool筛选,再到最后的单克隆筛选往往就要花费3-6个月的时间,而后还要进行稳定性传代实验以研究其稳定性,在得到高产单克隆后还要在上游细胞培养工艺开发阶段进行详细的优化与表征,综合起来其研发周期相对于同类药物来说显著延长,依各公司研发实力不同,其细胞株筛选至细胞培养工艺开发结束普遍需要6-12个月,甚至更长。而细胞株的构建在整个抗体产量的流程中占有较小的成本,但是在提高大批量表达的产量时却占有十分重要的地位。目前大部分的抗体药物大都是由CHO细胞进行表达的。CHO细胞能够进行正确的折叠、组装和进行类似于人抗体的翻译后修饰等能力,是生产重组蛋白类药物主要的宿主细胞。
细胞株开发的过程中,一般需要在一定的培养工艺平台基础上进行克隆筛选。中试生产申报药品临床试验( investigational new drug,IND) 时,一般会选定2~3个来自不同系列的克隆,其中1~2个克隆作为备选。
而培养工艺对最终生物制品的产量、质量和安全有巨大影响,其中以细胞培养基的选择最为重要,配制适合细胞生长和表达的培养基,包括基础培养基和补充物,常用的培养基包括DMEM、RPMI 1640 等。在筛选培养基和补料培养基时,初期流加培养时基础培养基和同品牌的补料培养基应该配对进行筛选。初步筛选之后,将基础培养基和补料培养基进行分类,如促进生长类型、维持活率类型、促进表达类型等。将培养基进行混合优化时,尽量将不同类型的培养进行组合,并且应用实验设计( design of experiment,DOE) 优化。
当前,以Amgen、Genentech公司为代表的生物制药巨头所使用的细胞株的蛋白表达量已达到5~10g/L,Pfizer、MedImmune 公司的个别细胞株甚至超过了10g/L。因此,细胞培养的生物反应器也从过去的大型化(20 kL)向小型化(1kL)、连续性、一次性转变。传统的不锈钢反应器在使用前需要进行彻底的清洁灭菌,而且有着更大的污染的风险,而一次性反应器可以大大节省准备的时间。带有搅拌器的袋式生物反应器,如 Hyclone 公司的 SUB、Sartorius公司的 BIOSTAT 和 Xcellerex 公司的 XDR-DSTB,正越来越多地被运用于治疗性抗体的生产。
以典型的单抗药物的商业化生产流程为例,上游工艺(细胞培养)一般采用以下步骤:细胞复苏与传代→扩增培养→细胞大规模培养→细胞分离(可属于下游工艺)。
将种子放置在恒温的水浴锅中,一般温度控制在如35℃左右,预热如30min,将工作细胞库细胞进行解冻复苏,根据工艺要求控制解冻时间,然后将解冻细胞加入至培养基中,离心分离后转入摇瓶中(如250 mL),进行摇瓶传代。注意控制CO 2 浓度、培养温度、培养时间等因素,同时也要根据工艺的要求控制接种的密度,控制细胞活率等要求。将上述的复苏种子细胞按照一定的密度稀释至新摇瓶中(如500 mL/2000mL),控制温度、CO 2 浓度、溶氧浓度、培养温度、培养时间、摇床摇摆速度、pH等因素,逐渐扩增细胞数量至满足一级种子罐的接种要求。
将摇瓶种子细胞按照一定的密度接种到一级种子罐内(如20 L),控制温度、CO 2 浓度、溶氧浓度、培养温度、培养时间、搅拌速度、pH、培养基等因素,逐渐扩增至细胞数量满足二级种子罐的要求。
将一级种子按照一定的密度接种到二级种子罐内(如50 L),控制温度、CO 2 浓度、溶氧浓度、培养温度、培养时间、搅拌速度、pH、培养基等因素,逐渐扩增至细胞数量满足种子罐的接种要求。
将二级种子按照一定的密度接种到种子罐内(如100 L),控制温度、CO 2 浓度、溶氧浓度、培养温度、培养时间、搅拌速度、pH、培养基等因素,逐渐扩增至细胞数量满足细胞发酵培养的接种要求。
种子扩增后要进入细胞大规模培养阶段,注意控制温度、CO 2 浓度、溶氧浓度、培养温度、培养时间、搅拌速度、pH、培养基等因素。细胞培养结束后,可采用离心分离或澄清过滤等方法进行抗体蛋白的分离纯化。
质量源于设计(QbD) 核心理念在于“质量是通过科学合理的设计得以实现的,而不是仅仅依靠最终检验出来的”。自2013年起,美国 FDA 对于新的药品批准申请,监管部门均要求采用QbD方法。近年来,QbD的理念已逐渐成为国内企业大多数药品生产和研发企业共识,在单抗制品的细胞培养工艺开发中应用的报道越来越多,基于QbD理念的药品开发基本流程,ICH Q8中提到的质量源于设计QbD的方法如下图所示:
基于QbD理念的细胞培养工艺开发:首先要界定目标产品的质量概况(QTPP),即以预先设定的目标产品质量概括(QTPP)为研发的起点,在了解关键物质属性(CMA)的基础上,通过试验设计(DOE),理解产品的关键质量属性(CQA),确立关键工艺参数(CPP),在原料特性、工艺条件、环境等多个影响因素下,建立能满足产品性能的且工艺稳健的设计空间(DS),并根据设计空间,建立质量风险管理,确立质量控制策略和药品质量体系,整个过程强调对产品和生产的认识。QbD可以帮助我们更好地理解产品和工艺,增强单抗制品的稳定性,降低GMP生产的复杂性和成本等。
在细胞培养的基础上,进行抗体表达是抗体药物生产的关键步骤。抗体表达包括转染、筛选和扩增等步骤。
将目标抗体的基因导入到宿主细胞中,实现目标蛋白质的表达。转染类型一般有稳定转染和瞬时转染两种。在单抗细胞株筛选稳定转染前通常通过瞬时转染得到一些抗体,进行质量分析,以初步判断抗体是否满足需要,或者进行一些前期的启动子、密码子等组件的优化。稳定转染中外源DNA既可以整合到宿主染色体中,也可能作为一种游离体存在。在CHO细胞中进行稳定转染时,外源DNA整合到CHO染色体上,未整合的游离态的DNA会随传代而丢失。
常用于哺乳动物细胞转染的方法有磷酸钙法、阳离子脂质体法、阳离子聚合物法和电穿孔法,使用最多的是阳离子脂质体法和电穿孔法。
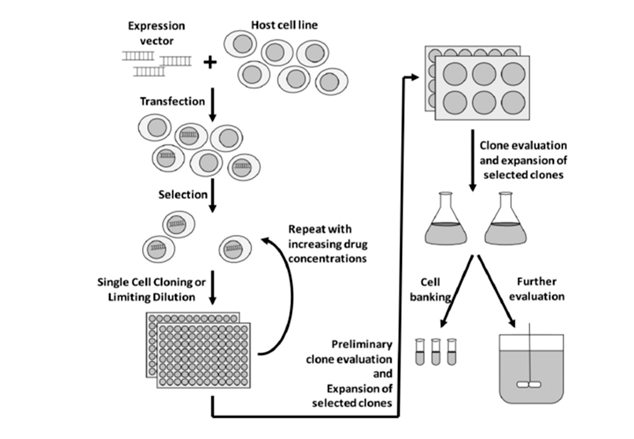
筛选高表达单克隆细胞株是细胞株构建的关键步骤,衡量标准包括抗体表达量、产品质量、代谢稳定性、细胞稳定性等。当目的基因被转染到宿主细胞内,并按照一定的细胞密度在合适的筛选压力下进行传代培养后便得到了细胞池。细胞池的表达量取决于转染的方式、筛选压力的作用以及目的基因整合情况。由于目的基因整合具有很大的随机性,即使用相同的方法进行转染和筛选,表达量依然会体现出极大的差异性,接下来就要从细胞池中筛选出高产稳定的细胞株。
CHO细胞转染之后,通常会做一个克隆池(pool),然后进行筛选。筛选策略主要涉及抗生素或药物的代谢途径,常见的筛选试剂包括puromycin、G418、MTX和MSX等。Puromycin为氨基糖甙类抗生素,通过干扰核糖体功能阻断哺乳动物细胞的蛋白质合成,来自链霉菌的pac基因具有解除嘌呤霉素(puromycin)毒性的作用,在筛选的时候,puromycin浓度一般在10~50ug/ml;G418也是一种氨基糖苷类抗生素,是稳定转染最常用的抗性筛选试剂之一,G418在筛选的时候一般浓度范围为200~1000ug/ml;MTX为叶酸拮抗剂,在细胞内经过转换后可抑制DHFR的活性,抑制核酸合成,引起细胞毒性。Schimke等的研究显示,随着MTX浓度的增加,绝大多数细胞死亡,但在极少数幸存下来的抗性细胞中,DHFR基因得以扩增,目的基因拷贝数随之增加,提高了表达量。MTX筛选时,一般浓度范围为25~1000 nmol/L;MSX筛选采用的是谷氨酰胺合成酶基因GS系统压力,谷氨酰胺合成酶(GS)扩增系统是新近发展的更有效的系统,具有更高的扩增效应。MSX筛选时,一般浓度范围为25~500umol/L。
常用的筛选克隆的方法包括:有限稀释法(limiting dilution cloning,LDC)、流式细胞仪分选法(fluorescence activated cell sorter,FACS)、半固体培养基筛选法等。其中有限稀释法因为其低成本和易于操作,曾广泛运用于克隆的筛选。该法是将细胞稀释到极低的细胞密度,并将稀释好的细胞置于96孔板中培养,使孔板中每个孔的理论细胞数小于1个,稀释后使用显微镜对96孔板整板拍照,以确保单克隆。经过一段时间的培养后使用酶联免疫吸附反应选取表达量高的细胞扩大培养。有限稀释法往往需要重复两次,以确保单克隆细胞株的纯度。
另一种开始广泛使用的方法是流式细胞仪分选法。将带有荧光标记的二抗和分泌抗体的CHO细胞混合孵育,分泌到细胞表面的抗体就能够被流式细胞仪检测到,从而利用其分选功能筛选出分泌多的细胞。为了使分泌到胞外的抗体能够维持在细胞膜表面,还可以使用微囊将细胞以及分泌的抗体包裹起来。目前,又有新的方法运用于流式细胞仪分选,即将绿色荧光蛋白(green fluorescent protein,GFP)的两个基因片段作为报告基因分别构建到抗体重链和轻链的表达载体上进行共转染,当这两个片段都整合到细胞内进行表达时,能够产生绿色荧光蛋白而发出绿色荧光,利用FACS进行分选得到高表达的细胞。使用该方法在转染完成后48h就能够进行检。
BB娱乐平台登录艾弗森
